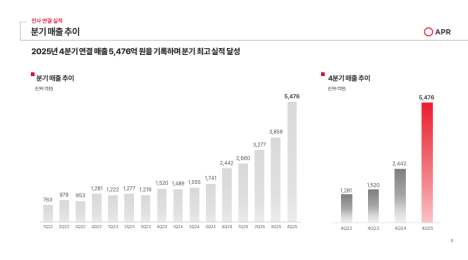
정부가 첨단재생의료 치료제도의 안정적 정착을 위해 의료기관 지정 및 치료·연구 절차 전반에 걸친 안전관리 체계를 강화한다.
첨단재생의료가 파킨슨병, 척수 손상, 희귀 근육질환 등 치료법이 마땅치 않은 난치환자에게 새로운 희망으로 떠오른 가운데, 잠재적 위험성과 윤리적 우려를 선제적으로 차단하기 위한 조치로 해석된다.
26일 보건복지부에 따르면 올해 2월 본격 시행된 ‘첨단재생의료 치료제도’의 실효성을 높이기 위해 관련 고시 개정안이 행정 예고됐다.
개정 대상은 ‘첨단재생의료 실시기관 지정 및 세포처리 업무 관련 준수사항 등에 관한 규정’과 ‘첨단재생의료 연구계획 작성·제출 및 심의 등에 관한 규정’ 두 가지다. 정부는 오는 29일까지 의견을 수렴해 최종안을 확정할 계획이다.
개정안이 시행되면 첨단재생의료기관으로 지정받기 위한 기준이 대폭 강화된다.
의료기관은 환자 안전을 최우선으로 고려한 표준운영지침(SOP)을 필수적으로 마련해야 한다. 병원 내 생명윤리위원회(IRB)와의 긴밀한 협업체계 구축도 의무화된다. 또한 첨단재생의료 실시에 필요한 장비와 시설을 완비하고 이를 지속적으로 관리하는 책임이 부여된다.
의료진의 전문성도 강화된다.
관련 법령, 생명윤리, 안전관리 등을 포괄하는 전문 교육 이수가 필수화된다. 지정 이후에도 정기적인 감독과 보고 체계를 유지해야 한다.
또한 인력, 시설, 표준지침에 변동이 있을 경우 이를 즉시 보고해야 하며, 치료에 사용하는 인체 세포 등은 위험도에 따라 인증된 세포처리시설에서만 공급받아야 한다.
치료 및 연구 계획 승인 절차도 훨씬 엄격해진다.
계획서에는 치료 목적, 대상, 안전성·유효성의 근거, 비용 산정 근거 등이 상세히 포함돼야 한다. 전문위원회와 심의위원회를 거치는 다단계 검토를 통해 승인 여부가 결정된다.
필요 시 현장 실사와 자료 보완도 요구될 수 있고, 명확한 반려 기준을 통해 부적절한 시도는 사전에 차단된다.
치료가 시작된 이후에도 환자 안전에 대한 모니터링이 체계화된다.
이상 반응 여부와 환자 상태를 정기적으로 보고하고, 이를 통해 만일의 사태에 신속히 대응할 수 있는 시스템을 마련할 계획이다. 장기적으로는 안전성과 유효성 데이터를 지속 축적해나갈 예정이다.
국내는 지난 10년간 350건 이상의 첨단재생의료 관련 임상연구가 이뤄졌으며, 100곳 이상의 의료기관이 첨단재생의료 실시기관으로 지정됐다.
정부는 이번 제도 개편을 통해 국내 줄기세포 치료제 개발 및 상용화에 다시금 동력을 부여하고, 환자에게 보다 안전하고 효과적인 치료 기회를 제공하겠다는 방침이다.