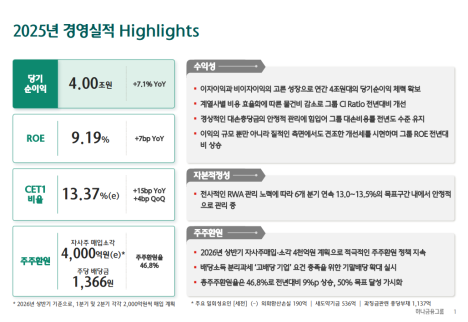
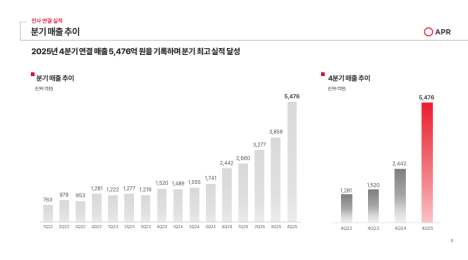
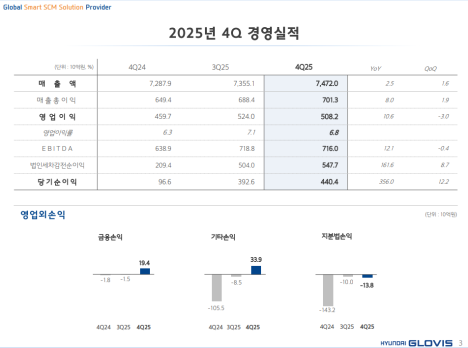
파로스아이바이오는 24일 차세대 급성골수성백혈병(AML) 치료제로 개발 중인 ‘PHI-101’이 유럽의약품청(EMA)으로부터 희귀의약품 지정을 받았다고 밝혔다.
유럽의약품청은 유럽 내 유병률 10만 명당 50명 미만인 희귀질환 중 기존 치료법이 없거나 새로운 치료 옵션이 절실한 경우, 중요한 치료적 이점을 제공할 것으로 기대되는 신약 후보에 희귀의약품 지위를 부여한다.
앞서 PHI-101은 2019년 미국 식품의약국(FDA)에서 희귀의약품 지정을 받았다. 지난해에는 국내 식약처로부터도 개발단계 희귀의약품으로 지정됐다.
파로스아이바이오는 PHI-101이 유럽에서 희귀의약품으로 지정됨에 따라 ▲신약 허가 심사 기간 단축 ▲임상시험 관련 자문 ▲품목 허가 신청 수수료 및 각종 개발 비용 감면 ▲신약 허가 후 10년간 시장 독점권 등 다양한 혜택을 받게 될 예정이다.
PHI-101은 파로스아이바이오가 자체 개발한 AI 신약개발 플랫폼 ‘케미버스(ChemiverseⓇ)’를 통해 도출한 혁신 항암 신약 후보물질이다. FLT3 단백질의 다양한 저항성 돌연변이를 표적한다.
PHI-101은 글로벌 임상1상에서 치료효능과 비임상에서 AI 기반 예측을 통한 심장독성 안전성을 확인했다.
PHI-101의 대상 질환인 AML은 기존 승인 치료제의 높은 재발률과 약물 내성 한계 등으로 인해 새로운 치료법이 절실한 희귀·난치성 질환이다. 특히 FLT3 변이가 있는 AML 환자는 그렇지 않은 경우 대비 생존율이 약 2배 낮고, 재발 위험이 높다.
윤정혁 파로스아이바이오 대표는 “PHI-101이 유럽의약품청으로부터 희귀의약품 지정을 받은 것은 글로벌 시장에서 그 혁신성과 잠재력을 공식적으로 인정받은 중요한 성과”라며 “기존 치료제에 한계가 있는 재발·불응성 급성 골수성 백혈병 환자들에게 하루빨리 새로운 치료 옵션을 제공할 수 있도록 개발에 더욱 속도를 낼 것”이라고 말했다.