세계폐암학회(WCLC)가 시작하고, 유럽암학회(ESMO) 초록공개가 되면서 자료들이 마구 나왔네요.
여러 번 말씀드렸지만, 회사들은 발표 전에 "우리 학회에 참석해요~"라고 한 번, 초록이 공개되거나 학회에서 발표한 후 발표내용을 한 번 더, 총 2회 정도 자료를 냅니다.
보통은 "학회에 참석해요~~"의 경우 일반적으로는 발표 전 기대감에 움직이는 경우가 많고요. 정말 관심이 많거나 학회 발표에서 센세이셔널한 내용이 있다면 그때 또 움직이기도 합니다.
일단 지금까지 파악한 곳들을 중심으로 내용 정리해 드리겠습니다.
현재까지 파악한 기업은 유한양행, HLB, 루닛, 티움바이오, 에스티팜, 네오이뮨텍, 유틸렉스, 에이비온, 그래디언트 등입니다.
HLB, 티움바이오, 유틸렉스는 "참석해요~~"정도로 상세내용은 아직 자료 안 냈네요.
먼저 김승민 미래에셋 위원이 잘 정리한 게 있어서 해당 자료 첨부합니다.
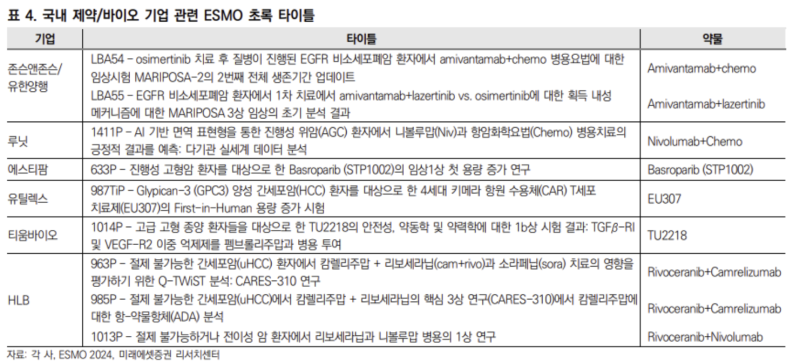
유한양행의 경우 LBA로 초록을 등록했는데요. 이 경우에는 발표 당일까지 ESMO 정책상 엠바고 처리됩니다.
LBA54의 경우에는 타그리소 치료 후 리브레반트+화학요법의 생존기간 분석 데이터고,
LBA55는 리브레반트+렉라자 vs 타그리소에서 내성을 얻는 기전에 대한 분석입니다.
개인적으로 지금 상황에서 이번 학회 발표로 유한주가가 크게 움직이기는 힘이 부족할 것으로 생각되며, 발표당일 시황이 중요할 것으로 보이네요. K-바이오의 경우 일반적으로 발표날은 셀온일 확률이 더 높았던 것 같습니다.
이제는 렉라자 관련한 유한양행 동력으로는 '리브레반트+렉라자' 유럽승인, 리브레반트SC 승인, 실제 마일스톤 유입 및 매출 찍히는 것을 봐야 할 것으로 생각됩니다.
추가로 '1270P - Lazertinib for patients with NSCLC harboring uncommon EGFR mutations: A single-arm, phase II multi-center trial'란 제목으로 박세훈 교수가 렉라자 임상결과를 발표하네요.
드문 EGFR 변이를 가진 폐암 환자에서 렉라자의 효능을 분석한 결과인데요.
위약군이나 대조군 없이 치료 전/후 렉라자의 효능을 분석한 결과 ORR 50%, 질병통제율(DCR) 91.7%를 보였습니다.
용어를 간단하게 정리하자면 다음과 같습니다.
💊전체반응률(ORR)= 항암제에 치료효과를 보인 환자 비율로 완전관해+부분반응으로 계산함
💊완전관해(CR)=암이 완전히 사라져 완치된 환자 비율
💊부분반응(PR)=암이 치료돼서 크기가 감소한 비율
💊안정상태(SD)=암이 커지지도, 작아지지도 않은 상태
💊질병통제율(DCR)= CR+PR+SD를 합친 비율
루닛은 오늘(작성일 기준 9일) 낸 자료로 대체하겠습니다.
루닛, ESMO서 '루닛 스코프 활용' 위암 항암 치료효과 예측 결과 발표 - 뉴스1
최근 진행성 위암 치료에서 면역 및 화학 항암제의 병용요법이 1차 치료제로 승인되어 사용되고 있다. 그러나 환자별 치료 반응이 다르게 나타나, 치료 효과를 정확히 예측할 수 있는 바이오마커 발굴 필요성이 대두돼 왔다. 이번 연구는 이런 임상적 요구를 해결하기 위한 노력의 일환으로 진행됐다.
분석 결과, 병용 치료 환자군은 단독 치료 환자군에 비해 무진행 생존 기간 중앙값(mPFS 8.2개월 vs 5.9개월)이 더 개선된 것으로 나타났다. 특히, 루닛 스코프 IO가 분류한 면역활성(Inflamed) 환자군(228명, 38.9%)에서 병용 치료 효과가 두드러졌다. 이들 면역활성 환자군은 단독 치료를 받은 환자군에 비해 mPFS(11개월 vs 5.8개월)가 약 2배 길었다.
반면, 루닛 스코프 IO가 분류한 비면역활성 환자군에서는 병용 치료 시 7.3개월, 단독 치료 시 5.9개월로 그 차이가 비교적 작았다. 이 밖에도 암세포가 반지 모양으로 관찰되고 예후가 좋지 않은 반지세포암종 환자보다 비반지세포암종 환자에서 병용 치료 효과가 더 좋은 것으로 나타났다.
아울러, 기존 바이오마커로 알려진 PD-L1의 복합양성점수(Combined Positive Score, CPS) 기준점인 CPS 5 이상/이하인 환자군 모두에서 루닛 스코프 IO가 분류한 면역활성 환자군은 비면역활성 환자군에 비해 무진행 생존 기간이 긴 것으로 관찰됐다. 이를 통해 PD-L1 발현 정도와 상관없이 질병 진행 및 사망 위험을 낮추고, 옵디보-화학요법 병용 치료 예후를 효과적으로 예측하는 독립적인 도구로 활용될 수 있음을 보여주었다
주가와는 별개로 하나하나 연구결과를 통해 레퍼런스를 채워나가고 있습니다. 이번 자료만 놓고 봐도, 제가 암에 걸리면 조직검사를 받고 루닛스코프IO로 한번 스크리닝해서 적절한 치료법을 받고 싶네요.
병 없이 생존할 수 있는 기간(PFS)이 거의 2배가량 차이가 나니까요.
이런 자료들이 쌓여서, 글로벌 제약사와 딜을 하거나 글로벌 대형병원들에 진입할 수 있는 근거가 됩니다.
HLB의 CARES-310 연구는 리보세라닙+캄렐리주맙 병용요법 임상3상의 연구명입니다. 해당 임상의 주요 결과는 이미 나왔고, 상대적으로 덜 중요한(?) 데이터들이라 주가에 크게 의미있을 것 같지는 않네요.
다만, 엘레바가 고형암을 대상으로 진행한 '리보세라닙+옵디보' 병용요법 고형암 임상1상 결과를 공개합니다.
A phase I study of rivoceranib combined with nivolumab in patients with unresectable or metastatic cancer
비절제성, 전이성 고형암 환자를 대상으로 한 임상1상 결과입니다.
리보세라닙 300mg, 400mg과 옵디보 200mg을 2주마다 투여해 최대약물용량(MTD)과 용량제한독성(DLT) 확인하기 위한 임상이었고, 총 30명을 대상으로 진행했네요.
3등급 이상 부작용도 보고되곤 했지만, 전반적으로 관리가능한 수준의 안전성 데이터를 확보했습니다.
효능측면으로는 전체 30명 중에서 ORR 16.7%, PR=16.7%, SD 63.3%를 보였습니다. DCR로는 80%네요.
리보세라닙 300mg+옵디보 200mg 투여군에서는 ORR 20%, PR 20%, SD 65%로 DCR 85%를 보였습니다.
환자 조건이 설명되어 있지는 않지만, 이전에 많이 치료받았거나 했을 것 같네요.
HLB에서 보도자료가 안 나오지 않을 것 같은데, DCR을 중심으로 나온다면 관심을 가져볼만할 것 같습니다.
네오이뮨텍도 오늘(9일) 자료를 냈습니다.
네오이뮨텍, 면역치료제 'NT-I7' 완전 관해 70%↑ "유럽종양학회서 본격 기술 이전 추진" - 프라임경제
이번 임상은 거대 B세포 림프종 (Large B-cell Lymphoma, LBCL) 환자들에게 CAR-T 치료제인 킴리아나 예스카타 혹은 브레얀지를 투여한 뒤, 21일 째에 NT-I7을 투여해 안전성, 내약성, 임상 2상 권장투여용량(RP2D)과 CAR-T 세포의 증폭 및 효능 지속성을 평가하는 것을 목표로 하고 있다.
NT-I7의 총 7단계의 용량군 중 360µg/kg과 480µg/kg인 중간 용량에서도 우수한 안전성 결과를 확인했다. 또한, NT-I7의 투여로 CAR-T 세포의 증폭, 증폭된 CAR-T 세포 수의 지속 효능, 줄기세포 특성(stemness)까지 강화되는 결과를 확인했다.
중간 결과에 따르면 전체 반응률(Overall Response Rate, ORR)은 81.1%(11명 중 9명)로 완전 관해(Complete Response·CR) 7명, 부분 관해(Partial Response,·PR)는 2명으로 확인되었다.
특히 킴리아와 NT-I7을 병용한 환자는 9명 중 7명이 치료 반응을 보였으며, 이 중 6명이 완전 관해에 도달했다.
킴리아는 LBCL 환자에게서 평균적으로 50%의 ORR을 기록하는 것으로 알려져 있는데, 이번 임상에서 킴리아와 NT-I7 병용 시 더 높은 치료반응이 관찰되었다. 예스카타 및 브레얀지와 NT-I7의 병용 환자에서도 각 1명씩 PR 및 CR 반응을 나타냈다.
CAR-T 치료제에서 흔히 보고되는 사이토카인 방출 증후군(Cytokine release syndrome, CRS)과 면역 효과 세포-관련 신경 독성 증후군(Immune effector associated neurotoxicity, ICANS)은 이번 NT-I7 병용 임상에서 보고되지 않았다.
추가적으로 경미한 Grade 1-2 수준의 치료 가능한 부작용만 발생해, NT-I7이 CAR-T 병용에서 높은 안전성을 보인 것으로 평가된다.
절대적인 수치만 놓고 보면 좋아 보이지만, 환자수가 너무 적어서 정말 좋은지는 잘 모르겠습니다.
CAR-T 치료제 자체는 완전관해(CR)가 잘 나오는데요. 이번 자료를 봐도 그렇죠. 또한 CAR-T와 병용한 임상데이터는 처음으로 보인 것 같은데, 이런 영향도 있는 것 같습니다.
일단 주 데이터는 노바티스의 킴리아+NT-I7을 함께 투여한 경우 9명 중 7명이 치료효과를 보였고, 이중 6명이 완전관해를 보였네요. 안전성 측면에서도 나은 것 같고요.
그런데 다시 말하지만, 환자수가 너무 적어서요. 후속 임상에서 어떻게 될지 계속 봐야겠네요.
에이비온은 지난 2일 자료를 냈고, 아직 상세자료는 안 나왔습니다.
최근 에이비온은 바바메킵으로 언플을 자주 하고 있습니다. 개인적으로 신뢰도는 낮은 기업이지만, 재료에 따른 끼는 훌륭한 곳입니다.
에이비온, ‘바바메킵 병용임상 경쟁력 강화 위한 액체생검’ ESMO 초록 채택 - 더바이오
EGFR TKI 치료를 받은 212명 환자에게서 2개월 이내의 질병 진행에 대해 분석한 결과, MET CTC가 8개 이상 검출된 환자들에게서 민감도 50%, 특이도 89.3%, 양성 예측도 55%, 음성 예측도 87.2%, 정확도 81.1%의 지표가 나타났다.
이는 MET CTC가 기존 영상 방법을 보완하는 지표 역할이 가능한 점을 시사한다고 회사는 설명했다.
에이비온 관계자는 “MET 변이를 가진 환자들을 조기에 선별해 적절한 치료를 적용할 수 있는 점을 의미하는 연구”라며 “바바메킵과 레이저티닙의 병용임상 시, MET CTC를 활용한 사전 검사(pre-screening) 과정을 통해 적절한 시점에 치료를 시작함으로써 임상 성공 가능성을 높일 수 있다”고 말했다.
바바메킵 병용임상은 1차 18명으로 시작해, 2차 60명, 3차 80명 등 최대 158명으로 진행된다. 바바메킵은 현재 미국, 한국, 대만 등에서 40명 규모 단독요법(코호트1)으로 글로벌 임상 2상을 진행 중이다. 병용임상은 이미 검증된 약물을 함께 사용해 반응률을 높이는 방식이다.
에스티팜도 탄키라제(TKRN) 저해제의 고형암 임상1상 결과를 자료로 내놨습니다.
에스티팜, 탄키라제 항암제 STP1002…임상 1상 결과 발표 - 디지털투데이
임상 신청일은 2019년 11월 25일, 승인일은 2019년 12월 20일로 임상시험의 목적은 진행성 고형암 환자에서 최대 내약용량(MTD)을 정의하고 임상2상 권장용량(RP2D)를 결정해 STP1002의 안전성 및 내약성을 평가하는 것이었다. 또한 다양한 용량의 STP1002 단독 요법에 대한 부작용과 약동학(PK)을 측정하고, 객관적인 방사선 사진 평가를 통해 항종양 활성을 관찰하고 기록하는 것도 목표였다.
이 임상시험은 2020년 7월 30일부터 2023년 3월 7일까지 진행됐으며 최대 42명의 환자를 대상으로 했다.
결과적으로 용량제한독성반응은 관찰되지 않아 최대 내약용량이 설정되지 않았으나 안정성 모니터링 위원회(SMC)의 회의에서 모든 코호트에 대한 통계분석 결과와 약동학 데이터를 바탕으로 최대 내약용량(MTD)과 임상 2상 권장용량(RP2D)을 결정했다. 이번 임상 1상으로 결정된 최대 내약용량과 임상 2상 권장용량은 360mg이다.
결과 자체가 좋고 나쁘다를 판단할 거리는 없고요. 임상 1상 목표에 충실히 달성했다 정도가 되겠습니다.
오늘(9일) 자료가 나오고도 크게 힘을 받지는 못했습니다.
동아에스티의 STP1002는 PARP(poly (ADP-ribose) polymerase) 패밀리에 속하는 TNKS1/2를 특이적으로 저해하는 저분자화합물이고, 암을 유발하는 KRAS 변이를 타깃해서 임상2상을 진행한다고 했었습니다.
STP1002 단독요법 보다는 작용기전상 시너지 효과를 MEK 저해제와 병용해서 임상개발을 할 계획입니다.
다만 에스티팜은 최근 바이오시큐어법안이 있죠. 9~13일 사이 표결이 예상되고 있는데, 면밀히 촉각 세우시고 대응하셔야겠습니다.
티움바이오도 지난달 29일에 자료를 낸 바 있습니다.
티움바이오, ESMO서 TU2218와 키트루다 병용 임상 결과 발표 - 한경
TU2218은 면역항암제의 활성을 방해하는 ‘형질전환성장인자(TGF-ß)’와 ‘혈관내피생성인자(VEGF)’를 동시에 차단하여 키트루다와 같은 면역항암제 효과를 극대화하는 기전의 경구용 치료제다.
TU2218과 키트루다 병용투여 임상 1b상은 미국에서 진행 중이다. 임상 1b상에 참여하는 진행성 고형암 환자는 키트루다 200mg을 3주에 한 번 정맥 투여 받는 것과 동시에 TU2218을 하루 두 번(BID) 2주간 경구 복용하게 되며, TU2218 투약 용량별 3개 그룹(52.5mg BID, 75mg BID 또는 97.5mg BID)으로 나뉘게 된다.
초록을 보니,
안전성은 확인했고 전체반응률(ORR)은 17%네요. 부분반응(PR) 17%, 안정상태(SD) 50%가 나왔습니다. CR+PR+SD를 다 더하는 질병통제율(DCR) 67% 수준입니다.
어떤 고형암인지, 이전에 얼마만큼 치료를 받았는지 등 세부조건이 없어서 효과에 대해서 판단하기는 어렵네요.
경구용 약물이 투여 편의성이 좋다는 점이 장점이지만, 효능이 떨어지면 굳이 사용할 필요가 있을지 모르겠습니다.
유틸렉스는 다른 기업들하고 함께 엮여서 나온 것은 있는데요. 상세자료가 또 나올 것으로 예상합니다.
번역기를 돌리시면 아시겠지만, GPC3 라는 것을 발현하는 간암에 대한 CAR-T 치료제인 EU307을 개발하고 있고, 용량증량 방식으로 진행한 임상1상 결과를 발표한다고 하는데요.
정작 효능 데이터는 없네요. 일단 임상1상에서 안전성, 내약성을 평가한다고 합니다.
다만, 사측에서 뿌리는 자료에 효능데이터가 첨부될 수 있으며, 이럴 경우 주가가 반응할 수 있습니다.
아이엠비디엑스도 오늘(9일) 자료가 나왔습니다.
아이엠비디엑스, ESMO서 혈액을 이용한 다중암 선별검사 '캔서파인드' 8개암종 성능 발표 - 머니투데이
아이엠비디엑스는 혈액으로 한 번에 8개 주요 암(대장암, 위암, 간암, 췌장암, 폐암, 유방암, 난소암, 전립선암)을 진단할 수 있는 캔서파인드를 개발했습니다.
최근 캔서파인드로 부각되면서 많이 올랐는데요, 실제 의료환경에서 쓰이는지는 나중에 매출 찍히는 것을 봐야겠죠. 아직 보험적용이 안돼서 시장 진입에 한계가 있는 것으로 알고 있습니다.
그래디언트도 발표자료를 내놨습니다.
그래디언트 바이오컨버전스, ESMO 2024 참석 - 바이오타임즈
암환자 관련 데이터뱅킹과 AI 모델에 관련한 것으로, 크게 임팩트는 없어 보이네요.
◆Personal Opinion
항암제는 전임상-임상에서는 매직워드인 완전관해(CR)와 질병통제율(DCR)을 신경 써서 봐야 합니다. 질병통제율은 CR+PR+SD가 다 합쳐져서, 실제 효능평가 시 좋은 지표는 아니지만 수치가 높게 나오게 되니 효능이 좋다는 인식을 줄 수 있기 때문입니다.
또한 학회 발표재료는 초록 공개 이후에는 보통 단발성인 경우가 많으니 잘 대응하셨으면 좋겠습니다.